Επιβεβαιώνεται η αποτελεσματικότητα της επαναθεραπείας με την ομαλιζουμάμπη της Novartis σε ασθενείς με χρόνια αυθόρμητη κνίδωση, μετά από διακοπή της θεραπείας
• Τα δεδομένα της μελέτης φάσης IIIb OPTIMA επιβεβαιώνουν εκ νέου ότι σχεδόν στα δύο τρίτα των ασθενών που έλαβαν θεραπεία με ομαλιζουμάμπη 300mg για 6 μήνες επετεύχθη ικανοποιητικός έλεγχος της νόσου1
• Στην περίπτωση που καταστεί αναγκαία η διακοπή της θεραπείας, τα δεδομένα κατέδειξαν ότι ποσοστό σχεδόν 90% των ασθενών με χρόνια αυθόρμητη κνίδωση (ΧΑΚ), στους οποίους είχε επιτευχθεί στο παρελθόν ικανοποιητικός έλεγχος της νόσου, επανέκτησαν αποτελεσματικό έλεγχο των συμπτωμάτων σε 12 εβδομάδες επαναθεραπείας με ομαλιζουμάμπη2
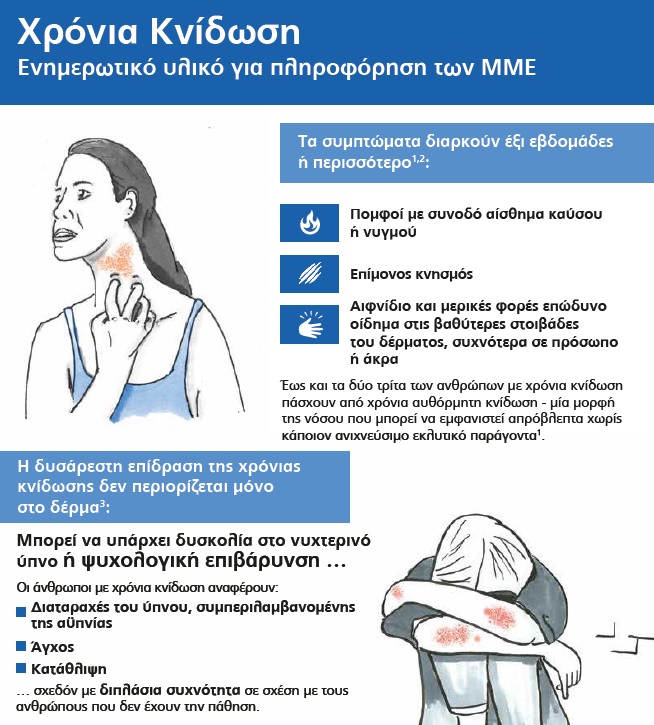
• Προηγούμενες μελέτες έχουν καταδείξει ότι η ανεπαρκώς ελεγχόμενη ΧΑΚ έχει σημαντικό αντίκτυπο στον ύπνο, την κοινωνική ζωή και την εργασία3
Η Novartis, ηγέτιδα δύναμη στην ανοσολογία και τη δερματολογία, ανακοίνωσε νέα δεδομένα, τα οποία καταδεικνύουν ότι ποσοστό σχεδόν 90% των ασθενών με χρόνια αυθόρμητη κνίδωση (ΧΑΚ) που είχαν ανταποκριθεί ικανοποιητικά στην αρχική θεραπεία με την ομαλιζουμάμπη, μετά από διακοπή της θεραπείας, επανέκτησαν τον έλεγχο των συμπτωμάτων της νόσου σε διάστημα 12 εβδομάδων επαναθεραπείας με ομαλιζουμάμπη, βάσει του κριτηρίου της Εβδομαδιαίας Βαθμολογίας Ενεργότητας της Κνίδωσης (UAS7) (UAS7≤6)2. Τα ευρήματα παρουσιάστηκαν στο 26ο συνέδριο της Ευρωπαϊκής Ακαδημίας Δερματολογίας και Αφροδισιολογίας που πραγματοποιήθηκε στη Γενεύη της Ελβετίας.
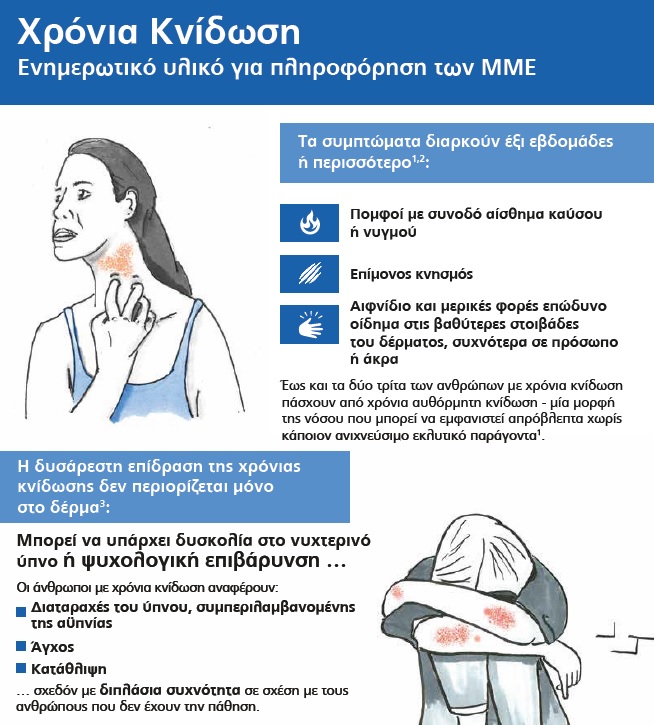
Η ΧΑΚ είναι μία δυσάρεστη δερματική πάθηση που εμφανίζεται αυθόρμητα και προκαλεί επίμονους πομφούς και/ή επώδυνο βαθύτερο οίδημα του δέρματος για 6 εβδομάδες ή περισσότερο4 Σύμφωνα με τις διεθνείς κατευθυντήριες οδηγίες για τη θεραπεία της νόσου, ο στόχος της θεραπείας για τη ΧΑΚ είναι η πλήρης εξάλειψη των συμπτωμάτων5,6. Για τους ασθενείς με ΧΑΚ που δεν πέτυχαν ικανοποιητικό έλεγχο των συμπτωμάτων τους με θεραπεία με Η1-αντιισταμινικά (ανταγωνιστές των Η1 υποδοχέων), η ομαλιζουμάμπη μπορεί να μειώσει ή να εξαλείψει τα συμπτώματα4,7,8. Η ομαλιζουμάμπη είναι η πρώτη και η μοναδική εγκεκριμένη θεραπεία για τους ασθενείς με ΧΑΚ που δεν εμφανίζουν ικανοποιητική ανταπόκριση στα Η1-αντιισταμινικά.
«Η ΧΑΚ μπορεί να έχει σοβαρό αντίκτυπο στην ποιότητα ζωής. Η απρόβλεπτη φύση της, σε συνδυασμό με το γεγονός ότι ορισμένοι ιατροί την παραβλέπουν εσφαλμένα, θεωρώντας την μια ήσσονος σημασία πάθηση, έχει ως αποτέλεσμα οι ασθενείς να μη λαμβάνουν επαρκή θεραπεία με αποτελεσματικό και μακροπρόθεσμο έλεγχο των συμπτωμάτων», δήλωσε ο Vas Narasimhan, Global Head, Drug Development και Chief Medical Officer της Novartis. «Εάν για κάποιο λόγο έχει διακοπεί η θεραπεία, αυτά τα δεδομένα βεβαιώνουν τους ασθενείς και τους ιατρούς ότι είναι δυνατή η ανάκτηση του αποτελεσματικό ελέγχου των συμπτωμάτων με την ομαλιζουμάμπη.»
Στη μελέτη OPTIMA, 314 συμμετέχοντες με συμπτώματα ΧΑΚ παρά τη λήψη H1-αντιισταμινικών τυχαιοποιήθηκαν σε θεραπεία για 24 εβδομάδες με ομαλιζουμάμπη 150mg ή 300mg. Για τα άτομα που ανταποκρίθηκαν ικανοποιητικά σε αυτήν την αρχική θεραπεία (UAS7≤6) ακολούθησε μία περίοδος διακοπής της θεραπείας και κατόπιν, εφόσον τα συμπτώματα επανήλθαν (UAS7>16), έλαβαν επαναληπτική θεραπεία2. Ο έλεγχος των συμπτωμάτων (UAS7≤6) επετεύχθη σε ποσοστό σχεδόν 90% των ασθενών που έλαβαν επαναθεραπεία, σε διάστημα τριών μηνών2. Η ομαλιζουμάμπη ήταν καλά ανεκτή και στις δύο δόσεις και κατά τη διάρκεια και των δύο περιόδων χορήγησης2.
Περαιτέρω δεδομένα από τη μελέτη OPTIMA κατέδειξαν ότι, μετά από 24 εβδομάδες θεραπείας, το 65% των ασθενών που έλαβαν μηνιαία θεραπεία με 300mg ομαλιζουμάμπη πέτυχαν ικανοποιητικό έλεγχο (UAS7≤6), σε σύγκριση με το 15% των ασθενών που έλαβαν θεραπεία με ομαλιζουμάμπη 150mg2. Στο διάστημα μεταξύ 8 και 24 εβδομάδων θεραπείας, ποσοστό 79% των ασθενών που ξεκίνησαν με ομαλιζουμάμπη 150mg δεν πέτυχαν ικανοποιητικό έλεγχο (UAS7>6) και η δόση τους αυξήθηκε στα 300 mg1. Μετά από 3 επιπρόσθετες δόσεις (300mg), το 45% αυτών των ασθενών πέτυχε έλεγχο των συμπτωμάτων, υποδηλώνοντας τη σημασία αύξησης της δόσης σε ορισμένους ασθενείς1.
Σχετικά με τη χρόνια κνίδωση και τη ΧΑΚ
Η χρόνια κνίδωση (ΧΚ) είναι μία σοβαρή νόσος που χαρακτηρίζεται από την επανεμφάνιση επίμονων πομφών ή/και ορισμένες φορές επώδυνου βαθύτερου οιδήματος του δέρματος για 6 εβδομάδες ή περισσότερο4. Σε οποιαδήποτε χρονική στιγμή, ο επιπολασμός της ΧΚ είναι έως 1% του παγκόσμιου πληθυσμού, ενώ έως και τα δύο τρίτα των ασθενών αυτών πάσχουν από ΧΑΚ6 – μία μορφή της νόσου που μπορεί να εμφανιστεί απρόβλεπτα χωρίς κάποιον ανιχνεύσιμο εκλυτικό παράγοντα6,9. Οι ασθενείς με ΧΚ παραμένουν συμπτωματικοί κατά μέσο όρο για περίπου 5 έτη, αλλά σε ορισμένους ασθενείς τα συμπτώματα μπορεί να επιμένουν για δεκαετίες10.
Παρόλο που η ΧΚ έχει σημαντικό αντίκτυπο στην ποιότητα ζωής των ασθενών, η έρευνα έχει δείξει ότι ορισμένοι ιατροί την παραβλέπουν, θεωρώντας τη μια ήσσονος σημασίας πάθηση10,11.
Σχετικά με την OPTIMA
Η OPTIMA είναι μια διεθνής, πολυκεντρική, τυχαιοποιημένη, ανοιχτού σχεδιασμού, μη συγκριτική μελέτη φάσης IIIb. Συνολικά, 314 ασθενείς με ΧΑΚ που εμφανίζουν συμπτώματα, παρά τη θεραπεία με ανταγωνιστές των υποδοχέων Η1, τυχαιοποιήθηκαν αρχικά σε αναλογία 4:3 σε θεραπεία με ομαλιζουμάμπη 150 ή 300 mg, για 24 εβδομάδες κατά την πρώτη περίοδο χορήγησης. Με βάση το UAS7, οι ασθενείς εισήλθαν κατόπιν σε μία από τις παρακάτω φάσεις: αύξηση της δόσης στα 300 mg (εάν αρχικά λάμβαναν θεραπεία με 150 mg και είχαν UAS7>6 σε οποιαδήποτε επίσκεψη μεταξύ των εβδομάδων 8-24), περίοδο απόσυρσης (εάν UAS7≤6) ή συνέχιση της θεραπείας για 12 εβδομάδες (εάν αρχικά λάμβαναν θεραπεία με 300 mg και είχαν UAS7>6 την εβδομάδα 24).
Σχετικά με την ομαλιζουμάμπη
Η ομαλιζουμάμπη είναι μια στοχευμένη θεραπεία που δεσμεύεται στην ανοσοσφαιρίνη Ε (IgE). Σε αλλεργικές νόσους και στο άσθμα, η δέσμευση της IgE από την ομαλιζουμάμπη μειώνει τα συμπτώματα, καταστέλλοντας πολλαπλούς μηχανισμούς ενεργοποίησης των κυττάρων, μεταξύ των οποίων και ορισμένους που οδηγούν σε απελευθέρωσης ισταμίνης. Η έρευνα για την κατανόηση του μηχανισμού δράσης της ομαλιζουμάμπης στη ΧΑΚ συνεχίζεται και θα μπορούσε να οδηγήσει στη βαθύτερη κατανόηση του τρόπου ανάπτυξης της νόσου.
Η ομαλιζουμάμπη είναι εγκεκριμένη για τη θεραπεία της ΧΑΚ σε περισσότερες από 80 χώρες, συμπεριλαμβανομένης της Ευρωπαϊκής Ένωσης, καθώς και για τη χρόνια ιδιοπαθή κνίδωση (ΧΙΚ), όπως είναι γνωστή στις ΗΠΑ και στον Καναδά. Η ομαλιζουμάμπη είναι εγκεκριμένη για τη θεραπεία του μέτριου έως σοβαρού ή του σοβαρού επίμονου αλλεργικού άσθματος σε περισσότερες από 90 χώρες, συμπεριλαμβανομένων των ΗΠΑ από το 2003 και της ΕΕ από το 2005, ενώ διαθέτει περισσότερα από 800.000 έτη έκθεσης ασθενών. Επιπλέον, η ομαλιζουμάμπη σε υγρή μορφή, σε προγεμισμένες σύριγγες έχει εγκριθεί στην ΕΕ και σε 10 χώρες εκτός της ΕΕ, συμπεριλαμβανομένων του Καναδά και της Αυστραλίας. Στις ΗΠΑ, η Novartis Pharmaceuticals Corporation και η Genentech, Inc. συνεργάζονται για την ανάπτυξη και την από κοινού προώθηση της ομαλιζουμάμπης.
Σχετικά με το Τμήμα Ανοσολογίας και Δερματολογίας της Novartis
Η Novartis είναι παγκόσμια ηγέτιδα δύναμη στην Aνοσολογία και τη Δερματολογία. Αλλάζουμε τις ζωές των ανθρώπων που πάσχουν από ανοσολογικές νόσους, εστιάζοντας στην εξειδικευμένη δερματολογία, στη ρευματολογία, στις αυτοφλεγμονώδεις παθήσεις, στις μεταμοσχεύσεις και στις εξειδικευμένες ηπατικές νόσους όπου υφίστανται σημαντικές μη ικανοποιούμενες ιατρικές ανάγκες. Το κορυφαίο προϊόν του Ομίλου, η σεκουκινουμάμπη, είναι μία καινοτόμος βιολογική θεραπεία που είναι εγκεκριμένη σε περισσότερες από 70 αγορές για τη θεραπεία της μέτριας έως σοβαρής ψωρίασης, της αγκυλοποιητικής σπονδυλίτιδας και της ψωριασικής αρθρίτιδας. Άλλα σημαντικά προϊόντα είναι η ομαλιζουμάμπη για τη χρόνια αυθόρμητη κνίδωση (ΧΑΚ)*, το εβερόλιμους και το μυκοφαινολικό οξύ για τις μεταμοσχεύσεις και η κανακινουμάμπη, που είναι εγκεκριμένο για τη θεραπεία σοβαρών σπάνιων παθήσεων, όπως ορισμένα σύνδρομα περιοδικού πυρετού. Επί του παρόντος, στο Τμήμα Ανοσολογίας και Δερματολογίας αναπτύσσονται, μεταξύ άλλων, πολλαπλές ενώσεις για την ηπατική νόσο.
*Στις ΗΠΑ, η Novartis Pharmaceuticals Corporation και η Genentech, Inc. συνεργάζονται για την ανάπτυξη και την από κοινού προώθηση της ομαλιζουμάμπης.
Δήλωση αποποίησης ευθύνης
Το παραπάνω δελτίο περιέχει δηλώσεις αναμενόμενων αποτελεσμάτων, συμπεριλαμβανομένων δηλώσεων όπως αυτές ορίζονται στην πράξη Private Securities Litigation Reform Act του 1995 των Ηνωμένων Πολιτειών. Οι δηλώσεις για μελλοντικές εκτιμήσεις μπορούν γενικά να εντοπιστούν από λέξεις όπως «δυνητικό», «μπορεί», «θα», «σχέδιο», «περιμένουμε», «προσδοκούμε», «αναμένεται», «πιστεύουμε», «δεσμεύεται», «ερευνητικό», «γραμμή» «κυκλοφορία», ή παρόμοιους όρους, ή από τις ρητές ή συνεπαγόμενες συζητήσεις που αφορούν στις δυνητικές εγκρίσεις της κυκλοφορίας, νέες ενδείξεις ή επισημάνσεις για τα ερευνητικά ή εγκεκριμένα προϊόντα τα οποία περιγράφονται σε αυτό το δελτίο τύπου, ή σε δυνητικά μελλοντικά έσοδα από τέτοια προϊόντα. Δεν θα πρέπει να εμπιστεύεστε άκριτα αυτές τις δηλώσεις. Αυτές οι δηλώσεις αναμενόμενων αποτελεσμάτων βασίζονται στα τρέχοντα οφέλη και προσδοκίες σχετικά με μελλοντικά συμβάματα, και υπόκεινται σε σημαντικούς γνωστούς και άγνωστους κινδύνους και αβεβαιότητες. Εάν υλοποιηθεί ένας ή περισσότεροι από αυτούς τους κινδύνους ή τις αβεβαιότητες, ή εάν οι υποκείμενες υποθέσεις αποδειχθούν λανθασμένες, τα πραγματικά αποτελέσματα μπορεί να διαφέρουν σημαντικά από αυτά που εκτιμώνται στις δηλώσεις αναμενόμενων αποτελεσμάτων. Δεν μπορεί να υπάρξει καμία εγγύηση ότι τα ερευνητικά ή εγκεκριμένα προϊόντα που περιγράφονται σε αυτό το δελτίο τύπου θα υποβληθούν για έγκριση ή θα εγκριθούν για πώληση ή για οποιεσδήποτε επιπλέον ενδείξεις ή επισήμανση σε οποιαδήποτε αγορά ή σε κάποια συγκεκριμένη χρονική στιγμή. Επίσης, δεν μπορεί να υπάρξει καμία εγγύηση ότι αυτά τα προϊόντα θα σημειώσουν εμπορική επιτυχία στο μέλλον. Συγκεκριμένα, οι προσδοκίες μας σχετικά με αυτά τα προϊόντα μπορεί να επηρεαστούν, μεταξύ άλλων, από τις αβεβαιότητες που υπάρχουν στην έρευνα και την ανάπτυξη, συμπεριλαμβανομένων μη αναμενόμενων νέων κλινικών δεδομένων και πρόσθετων αναλύσεων υφιστάμενων κλινικών δεδομένων, κανονιστικές ενέργειες ή καθυστερήσεις ή κυβερνητικούς κανονισμούς εν γένει, τη δυνατότητά μας να κατοχυρώσουμε και να διατηρήσουμε δίπλωμα ευρεσιτεχνίας ή άλλη προστασία πνευματικής ιδιοκτησίας, τις συγκεκριμένες προτιμήσεις συνταγογράφησης των ιατρών και των ασθενών, παγκόσμιες τάσεις περιορισμού της δαπάνης της υγειονομικής περίθαλψης, συμπεριλαμβανομένων πιέσεων σχετικά με τις τιμές και τις αποζημιώσεις από την κυβέρνηση, τον πληρωτή ή το ευρύ κοινό, γενικές οικονομικές και βιομηχανικές καταστάσεις, συμπεριλαμβανομένων των επιδράσεων του εμμένοντος ασθενούς οικονομικού και χρηματοοικονομικού περιβάλλοντος σε πολλές χώρες, ζητήματα ασφάλειας ποιότητας ή κατασκευής και άλλους κινδύνους και παράγοντες που αναφέρονται στο τρέχον Έντυπο 20-F της Novartis AG που έχει κατατεθεί στην Επιτροπή Αξιών και Χρηματιστηρίου Αξιών των Η.Π.Α. Η Novartis παρέχει τις πληροφορίες που περιέχονται σε αυτό το δελτίο τύπου με σημερινή ημερομηνία και δεν αναλαμβάνει καμία υποχρέωση να ενημερώσει τυχόν αναμενόμενες δηλώσεις που περιέχονται στο παρόν δελτίο συνεπεία νέων πληροφοριών, μελλοντικών συμβάντων ή άλλως.
Λίγα Λόγια για τη Novartis
Η Novartis παρέχει καινοτόμες λύσεις στον τομέα της υγείας που καλύπτουν τις εξελισσόμενες ανάγκες των ασθενών και της κοινωνίας. Με έδρα στη Βασιλεία της Ελβετίας, η Novartis προσφέρει ένα διαφοροποιημένο χαρτοφυλάκιο για την καλύτερη δυνατή κάλυψη των εν λόγω αναγκών: καινοτόμα φάρμακα, οφθαλμιατρικά προϊόντα και χαμηλού κόστους γενόσημα και βιοομοειδή φάρμακα. Η Novartis κατέχει ηγετική θέση παγκοσμίως σε αυτούς τους τομείς. Το 2016, ο Όμιλος σημείωσε καθαρές πωλήσεις ύψους 48,5 δις δολαρίων ΗΠΑ, ενώ οι δαπάνες Έρευνας και Ανάπτυξης σε ολόκληρο τον Όμιλο ανήλθαν σε 9,0 δις δολάρια ΗΠΑ περίπου. Οι εταιρείες του Ομίλου Novartis απασχολούν περίπου 119.000 συνεργάτες πλήρους απασχόλησης. Τα προϊόντα της Novartis είναι διαθέσιμα σε περίπου 155 χώρες σε ολόκληρο τον κόσμο.
Στην Ελλάδα, η Novartis (Hellas) Α.Ε.Β.Ε. δραστηριοποιείται στα συνταγογραφούμενα φαρμακευτικά ιδιοσκευάσματα. Τα κεντρικά γραφεία βρίσκονται στη Μεταμόρφωση Αττικής και απασχολούνται 500 περίπου άτομα.
Παραπομπές
1. Gulliver W et al. Omalizumab Dose Step-Up and Treatment Response in Patients With Chronic Idiopathic Urticaria / Chronic Spontaneous Urticaria: Results from the OPTIMA Study. Poster presented at the 26th Congress of the European Academy of Dermatology and Venereology (EADV), 13-17 September 2017.
2. Lynde C et al. Omalizumab Retreatment of Patients With Chronic Idiopathic Urticaria / Chronic Spontaneous Urticaria Following Return of Symptoms: Primary Results of the OPTIMA Study. Presented at the 26th Congress of the European Academy of Dermatology and Venereology (EADV), 13-17 September 2017.
3. Maurer M et al. The burden of chronic spontaneous urticaria is substantial: Real-world evidence from ASSURE-CSU. Allergy 2017. Advanced online publication. DOI:10.1111/all.13209
4. Saini S, Bindslev-Jensen C, Maurer M et al. Efficacy and Safety of Omalizumab in Patients with Chronic Idiopathic/Spontaneous Urticaria Who Remain Symptomatic on H1 Antihistamines: A Randomized, Placebo-Controlled Study. J Investigative Dermatology 2014;135:67-75
5. Zuberbier T et al. The EAACI/GA(2) LEN/EDF/WAO Guideline for the definition, classification, diagnosis, and management of urticaria: the 2013 revision and update. Allergy 2014; 69(7):e1-29.
6. Maurer M et al. Unmet clinical needs in chronic spontaneous urticaria. A GA2LEN task force report. Allergy 2011; 66: 317-330.
7. Maurer M, Rosén K, Hsieh HJ et al. Omalizumab for the treatment of chronic idiopathic or spontaneous urticaria. NEJM. 2013; 368(10):924-35.
8. Kaplan A, Ledford D, Ashby M et al. Omalizumab in patients with symptomatic chronic idiopathic/spontaneous urticaria despite standard combination therapy. J Allergy Clin Immunol. 2013 Jul;132(1):101-9.
9. British Association of Dermatologists. Urticaria and angioedema. Available online at: http://www.bad.org.uk/shared/get-file.ashx?id=184&itemtype=document. Last accessed June 2017.
10. Sánchez-Borges M et al. Diagnosis and Treatment of Urticaria and Angioedema: A Worldwide Perspective. WAO Journal 2012; 5: 125-147.
11. O’Donnell BF et al. The impact of chronic urticaria on the quality of life. British Journal of Dermatology 1997; 136: 197-201.













































1.jpg)



















.jpg)






.jpg)



_.jpg)
.jpg)








